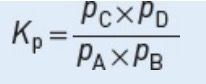Ionic equations, acids and bases
根据Bronsted-Lowry理论,酸(acid)是质子供体,碱(base)是质子受体。一些酸是双质子(diprotic),因此可以提供两个质子(比如硫酸)。有一些碱也是双质子,可以接受两个质子(比如碳酸根离子)。
可以使用指示剂(indicator),例如甲基橙(methyl orange)和酚酞(phenophthalein)来确定反应的终点(end-point)。标准溶液(standard solution)应为浓度(concentration)为。
滴定法(tritration)中,标准溶液参与中和反应,两种溶液的体积都准确测量,便可计算出未知溶液的浓度。
反向滴定(back tritration)中,滴定法用于计算反应后剩余的酸或碱的摩尔量。
需要掌握的公式有

需要掌握的物质及其化学方程式有


Oxidation and reduction
Oxidation 氧化——减少电子
Reduction 还原——增加电子
Oxidising agent 氧化剂
Reducing agent 还原剂
Redox reaction 氧化还原反应中,氧化剂失去的电子和还原剂得到的电子数量相当。
Oxidation number 氧化数(化合价)
单质里原子的化合价为0.
在化合物里,电负性越强的元素化合价为负数,例如氟(F)一半化合价为-1.
在化合物里所有元素的化合价总和为0.
在多数化合物中,氧元素(O)化合价为-2,氢元素(H)为+1.在所有的离子中,化合价的总和和离子所带电荷数相等。
Rates of reaction
Kinetics 动力学是研究反应的反应速率,也就是反应物消失的速度或是产物产生的速率。
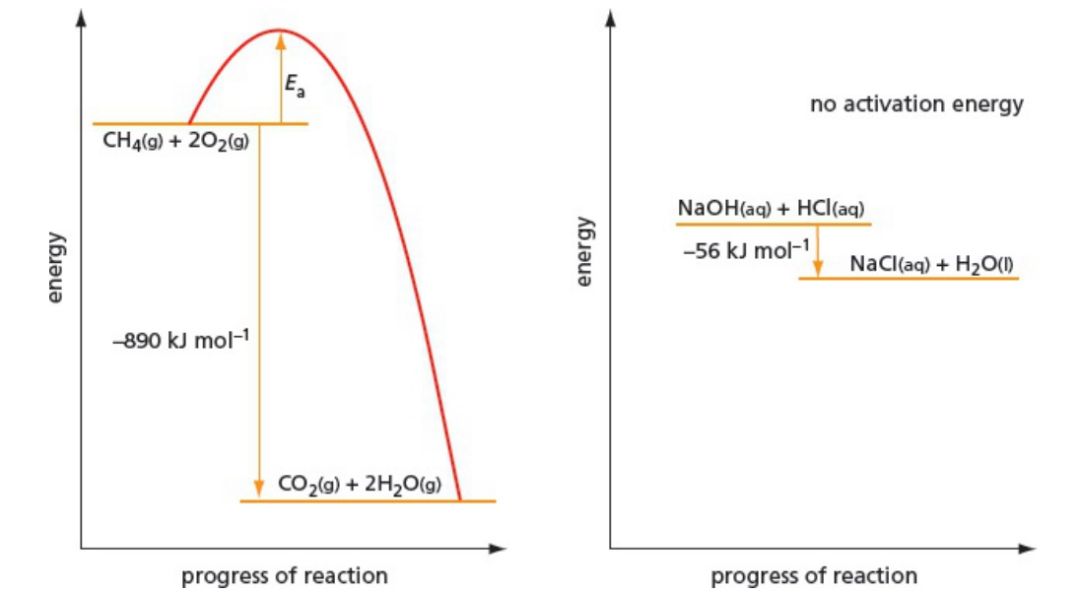
Activation energy barrier 反应速率由激活能壁垒决定的,而不是熵变的大小。
测量反应速率的物理方法有:
——测定随时间变化的反应生成的气体体积
——测量随时间变化的反应物的重量
——根据颜色随时间的变化判定(colorimeter)
测量反应速率的化学方法有:
——根据一定时间间隔提取反应物,然后用化学分析法测定(例如滴定法)
——使用clock method
反应速率可以根基反应物浓度-时间的斜率,或生成物浓度-时间的斜率得到。
反应物越集中,速度越快,因为分子间碰撞的机会更多。同理,提高压力在气态的反应中起到相同的作用。
温度提高,反应速率提高,主要是因为由于能量足够支持更多的分子间碰撞。
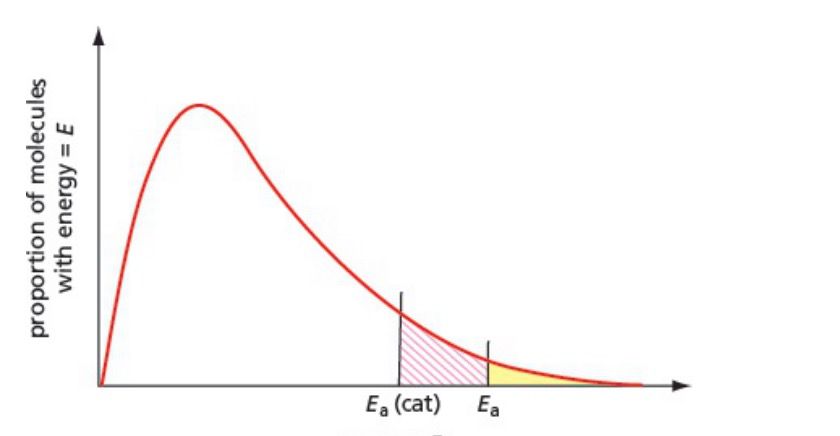
Energy distribution curve 能量分布曲线可以展示在不同能量范围内的分子占比。

只有能量大于激活能的分子能够发生反应,这部分是能量分布在激活能右边的区域。
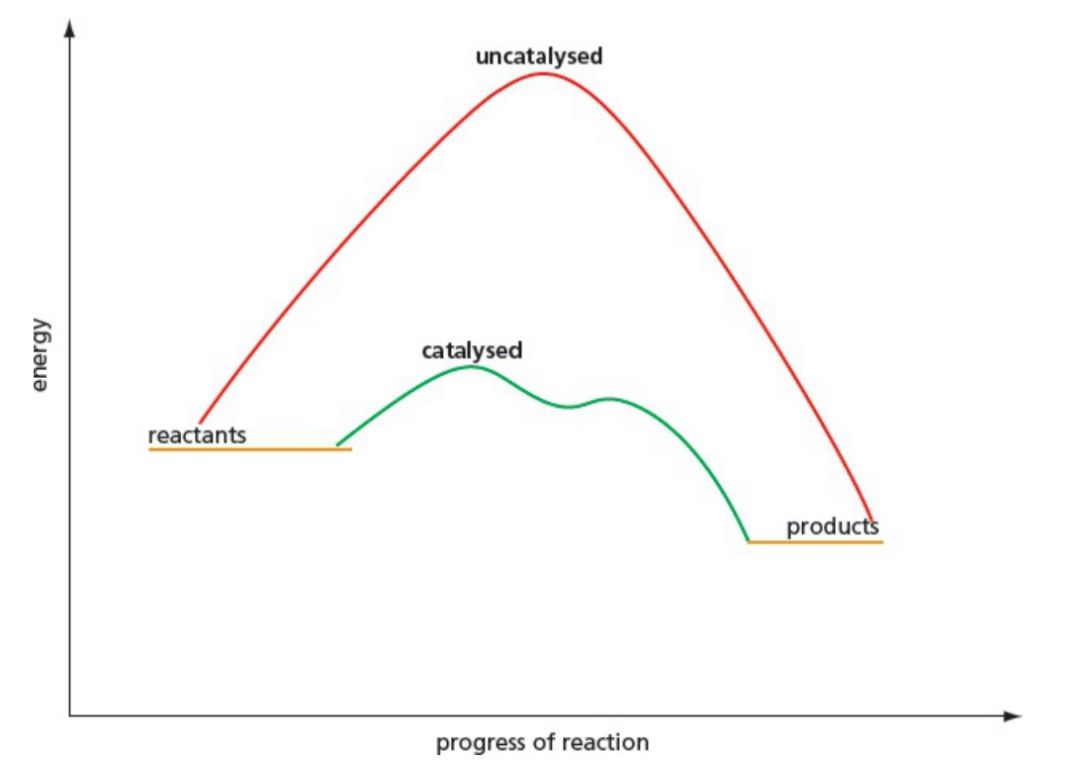
Catalyst 催化剂是反应的捷径——降低激活能。
Equilibria
很多化学反应无法完全——他们会处于动态平衡(dynamic equilibrium),平衡位置会根据反应条件的改变而发生改变。变化的方向可以根据Chatelier's Principle来预测。
反应物浓度增加会使平衡向右移动。
在含有气相的反应中提高压力时,平衡会向气体少的方向移动。提高温度,会使得平衡向吸热的反应方向移动。
减小颗粒的尺寸或者提高表面积可以加速反应,但是不使平衡移动。
加入催化剂,只影响反应速度,不使平衡移动。
Equilibrium constant 平衡常数

如果反应组分都是气体,平衡常数也可以用组分的压力表示: